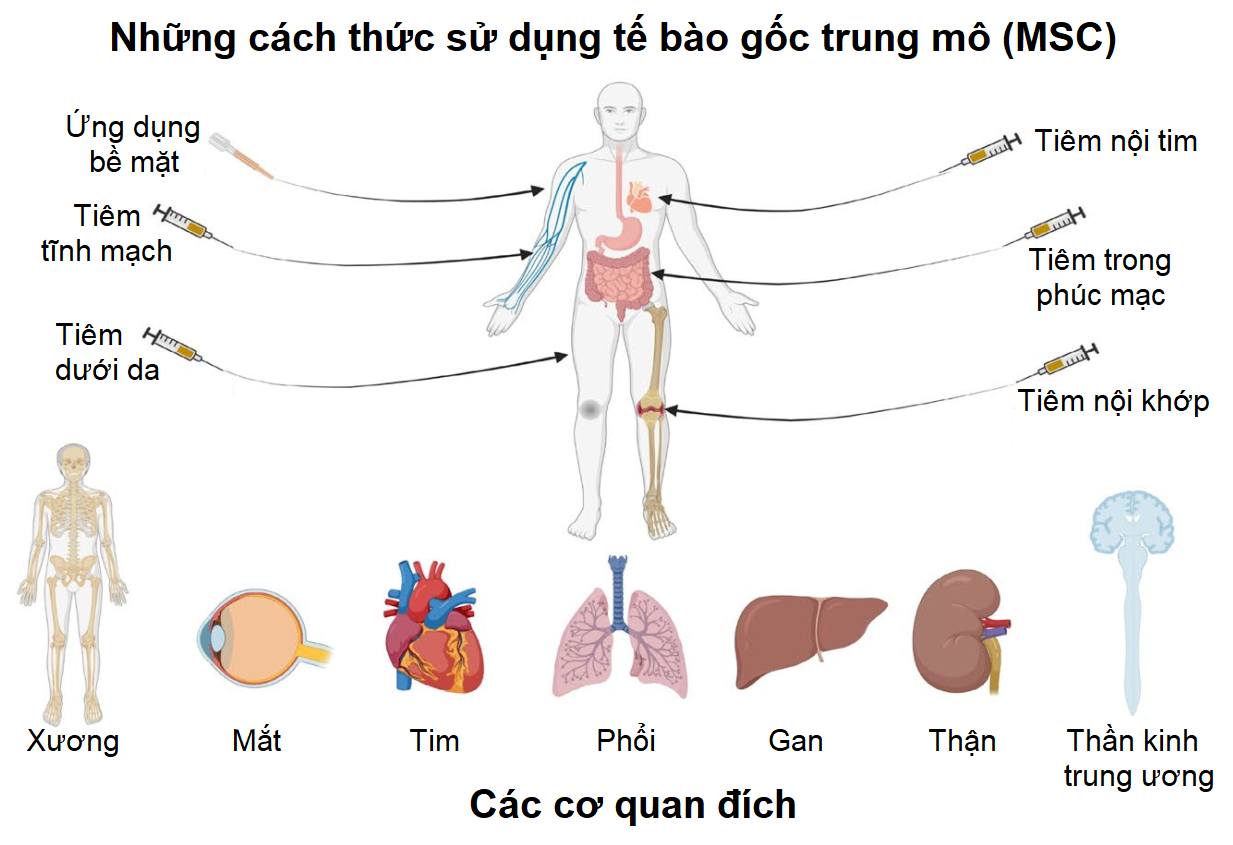
Hiện tại trên thế giới có 11 sản phẩm tế bào gốc trung mô được cấp phép bởi cơ quan quản lý tại quốc gia/khu vực sở tại (sản phẩm là dòng tế bào hoặc quy trình sản xuất), ngoài ra có 1 sản phẩm đã được phê duyệt nhưng đã rút giấy phép. Các sản phẩm này chủ yếu ở các quốc gia châu Á, chỉ có 1 sản phẩm được FDA Hoa Kỳ phê duyệt và không còn sản phẩm nào ở châu Âu.
* Hàn Quốc
1. Queencell (Anterogen), sản phẩm MSC mô mỡ tự thân, được cấp phép năm 2010 để điều trị tổn thương mô dưới da
2. Cellgram AMI (Pharmicell), sản phẩm MSC tủy xương tự thân, được cấp phép năm 2011 để điều trị nhồi máu cơ tim cấp tính
3. Cupistem (Anterogen), sản phẩm MSC tủy xương tự thân, được cấp phép năm 2012 để điều trị lỗ rò hậu môn trong bệnh Cohn
4. Cartistem (Medipost), sản phẩm MSC dây rốn đồng loài, được cấp phép năm 2012 để điều trị tổn thương sụn đầu gối
5. NeuroNataR (Corestem), sản phẩm MSC tủy xương tự thân, được cấp phép năm 2014 để điều trị teo xơ cứng cột bên
* Nhật Bản
6. Temcell HS (JCR Pharmaceuticals), sản phẩm MSC tủy xương đồng loài, được cấp phép năm 2015 để điều trị mảnh ghép chống chủ (GvHD)
7. Stemirac (Nipro Corporation), sản phẩm MSC tủy xương tự thân, được cấp phép năm 2018 để điều trị chấn thương tủy sống
* Ấn Độ
8. Stempeucel (Stempeutics), sản phẩm MSC tủy xương đồng loài, được cấp phép năm 2016 để điều trị chấn thương tủy sống
* Iran
9. MesestroCell (Cell Tech Pharmed), sản phẩm MSC tủy xương tự thân, được cấp phép năm 2018 để điều trị viêm xương khớp
* Trung Quốc
10. Ruibosheng (Platinum Life Excellence), sản phẩm MSC dây rốn đồng loài, là sản phẩm được cấp phép mới nhất – ngày 02/01/2025, điều trị mảnh ghép chống chủ (GvHD) cấp tính kháng steroid
* Hoa Kỳ, Canada, New Zealand
11. Prochymal, sau này đổi tên thành Ryoncil hay tên riêng Remestemcel-L (Mesoblast), sản phẩm MSC tủy xương đồng loài, được cấp phép tại Hoa Kỳ năm 2024, trước đó được cấp phép tại Canada và New Zealand cùng năm 2012, điều trị mảnh ghép chống chủ (GvHD) cấp tính kháng steroid
* Châu Âu (sản phẩm đã rút giấy phép)
12*. Alofisel (Takeda/TiGenix), sản phẩm MSC mô mỡ đồng loài, được cấp phép năm 2018 để điều trị lỗ rò hậu môn trong bệnh Cohn, đã rút giấy phép ngày 13/12/2024 sau khi dữ liệu cho thấy lợi ích lâm sàng là không hợp lý.